DIAGRAMA DE FASES E ESTUDO DE GASES IDEAIS
DIAGRAMA DE FASES
Quando dizemos que a temperatura de ebulição da água é 100°C, no nível do mar, essa última descrição indica que, dependendo da localidade (pressão local) a temperatura de ebulição pode mudar. Quanto maior a pressão (Pressão mede força por unidade de área. O estudo dessa grandeza é abordado no módulo de hidrostática) exercida nas moléculas, mais difícil será para haver mudança de estado físico, ou seja, maior será a temperatura de fusão/ebulição. Podemos concluir também que, quanto menor a pressão local, mais fácil será de a substância sofrer mudança de estado físico, o que significa dizer que menor será sua temperatura de fusão/ebulição.
O planeta Terra tem uma coluna de aproximadamente 8 Km de ar (atmosfera). A pressão no nível do mar é maior que a pressão de uma cidade que fica no alto de uma montanha, como La Paz, por exemplo. A temperatura a 40 km de distância da superfície da Terra é em torno de -70°C, mas como a pressão é baixíssima, a água, nessa localidade, entra em ebulição.
Vamos imaginar a seguinte situação: uma pessoa aquece certa quantidade de água até começar a entrar em ebulição. Após esse instante, retira, com uma seringa, um pouco dessa água em ebulição. Com a extremidade da seringa vedada, irá pressioná-la até o máximo que conseguir, aumentando a pressão em seu interior. Nesse momento, perceberá a ausência de bolhas na água. Ao voltar, rapidamente, para a posição inicial, a água voltará a borbulhar. Com essa demonstração simples, podemos perceber a influência da pressão na organização molecular.
Com o gráfico abaixo, chamado diagrama de fases, poderemos visualizar melhor essa relação entre pressão x temperatura e as mudanças de estados físicos:

Densidade
Conforme comentado no capítulo anterior, a temperatura de uma substância influencia em sua densidade. Quanto maior a temperatura, maior o volume ocupado do material, devido à dilatação que sofrerá, ou seja, menor será a sua densidade (d):
e
,logo:
A única substância que não segue essa regra é a água. Dizemos que, entre 0°C e 4°C, no nível do mar, a água apresenta um comportamento anômalo. A geometria molecular da água no estado sólido faz com que, ao contrário das demais substâncias, ocupe mais espaço que a água no estado líquido. Ou seja, a densidade do gelo é menor que a da água.
Por isso que o gelo flutua na água (no capítulo de hidrostática, esse assunto é melhor abordado). Basta colocar um copo cheio de água no freezer. O gelo formado ocupará um espaço maior que o copo, formando gelo ao redor do copo. A densidade da água a 4°C é maior que a densidade a 2°C, por exemplo. Mas fora dessa faixa, segue o padrão. Por exemplo, a densidade da água a 14°C é maior que a densidade da água a 18°C.

MASSA ESPECÍFICA X DENSIDADE
Há uma pequena diferença entre densidade e massa específica. Essa diferença aprece quando temos um objeto oco, por exemplo. A densidade é o quociente entre a massa total e o volume total do objeto, já a massa específica é o quociente entre a massa do material e o volume do material.
Nos navios, por exemplo, apesar de a massa específica do aço seja maior do que a massa específica da água, a densidade de um navio – assumido uma estrutura “fechada”, é certamente menor do que a da água. Para líquidos e gases as expressões densidade e massa específica acabam sendo utilizadas como sinônimos.
UMIDADE RELATIVA DO AR
A umidade relativa é a relação entre a pressão de vapor do ar e a pressão de vapor do ar obtida em condições de equilíbrio ou saturação sobre uma superfície de água líquida ou gelo, ou seja, é a relação entre a quantidade de água existente no ar (umidade absoluta) e a quantidade máxima que poderia haver na mesma temperatura (ponto de saturação).
Onde p é a pressão parcial de vapor de água do ar e ps é pressão de vapor nas condições de equilíbrio, também chamada pressão de vapor de saturação.
Exercício resolvido:
A tabela a seguir apresenta alguns valores da pressão de saturação do vapor d’água atmosférico, para cada temperatura.

Numa certa massa de ar atmosférico a 20° C, a pressão parcial no vapor d’água é 10 mm de mercúrio. Qual é a umidade relativa do ar nessas condições?
Resolução:
Encerrada a primeira parte dos nossos estudos, iremos entender o que sãos gases ideais e suas relações entre pressão, volume e temperatura.
GASES PERFEITOS OU IDEAIS
Começaremos com as características de um gás perfeito ou ideal, ou seja, o que defini um gás como ideal ou perfeito:
É composto de partículas puntiformes (sem dimensão).
Não há força elétrica entre as partículas (distância grande entre elas).
Há ocorrência de interação apenas durante as colisões, que são perfeitamente elásticas, ou seja, não há perda de energia após as colisões.
O estudo do comportamento dos gases resultou em uma relação entre as variáveis: temperatura (T), pressão (P), volume (V) e número de mols do gás (n). Essa relação matemática é conhecida como a Lei dos Gases Ideais (Equação de Clapeyron).
Onde R é a constante dos gases perfeitos, de valor 0,082 atm.L/mol.K ou 8,31 J/mol.K (S.I.).
TRANSFORMAÇÕES GASOSAS (SEM ALTERAÇÃO NA QUANTIDADE DE GÁS DO RECIPIENTE)
Mais para frente iremos estudar mais detalhadamente cada uma dessas transformações.
Transformação Isobárica
É quando um gás sofre alteração no seu volume e temperatura, mas sem alterar a sua pressão.

Pela equação dos gases perfeitos, podemos perceber que, se o gás vai de 1 para 2, seu volume aumenta, e como a pressão é constante, significa que a temperatura do gás aumenta. Se for de 2 para 1, a temperatura diminui.
OBSERVAÇÃO
Para realizar essa relação ou qualquer outra que seja originada da equação dos gases perfeitos, a temperatura deve estar sempre em Kelvin. Basta ver as unidades da constante R.
Transformação Isotérmica
Pressão e volume são inversamente proporcionais. A temperatura permanece inalterada.

Analogamente ao caso anterior, teremos que:
Observe que:
Como toda hipérbole é escrita pela relação:
A isoterma também é uma hipérbole. Quanto maior o produto P.V, maior T, ou seja, quanto mais afastada a hipérbole está da origem, maior será a temperatura do gás durante o processo. Neste casso, T2 > T1.
Transformação Isocórica/ Isovolumétrica/ Isométrica
Nesse caso a pressão e a temperatura são diretamente proporcionais. O volume é constante.

Analogamente:
OBSERVAÇÃO
Os gráficos podem ser ,
e etc. A representação
é a mais comum. Neste último caso, por exemplo, poderíamos ter escolhido
para representar a transformação:
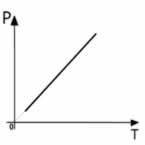
OBSERVAÇÃO
A reta nunca tocará o zero Kelvin, O domínio desta função é .
Exercícios resolvidos
1) Certo gás está confinado em um recipiente hermeticamente fechado e inextensível. A temperatura do recipiente aumenta, aumentando a temperatura do gás em seu interior de 27°C para 227°C. Qual a relação entre a pressão final e inicial que o gás está submetido?
Resolução:
Como o recipiente está hermeticamente fechado, o número de mols (n) é constante.
Inextensível, ou seja, volume constante.
Então:
Perceba que transformamos °C em K.
E se houver alteração no número de mols? Vamos ver um exemplo dessa situação:
2) Ao abrir uma garrafa de um refrigerante, nota-se que certa quantidade de gás escapará. Vamos supor que, durante certo intervalo de tempo, 10% do gás escapou. Qual a relação entre as pressões inicial e final sofrida pelo gás? Vamos considerá-lo ideal.
Resolução:
Antes de a garrafa ser aberta:
Depois de o gás vazar:
Dividindo a 1ª pela 2ª:
Algo que naturalmente já sabíamos, após abrirmos um refrigerante, a pressão no interior da latinha reduz, se igualando à pressão externa.
CADASTRE-SE
E receba em primeira-mão todas as novidades dos Vestibulares, Ofertas, Promoções e mais!


