PROTEÍNAS I

Qualquer molécula de aminoácido tem um grupo carboxila (-COOH) e um grupo amina (-NH2) ligados a um átomo de carbono

O que faz um aminoácido (AA) se diferenciar de outro é o seu radical (R). Esse radical pode ser um simples hidrogênio, um grupo metil (CH3) ou grupos mais complexos.
Existem 20 aminoácidos diferentes presentes na natureza que são a “matéria–prima” para a síntese de todas as proteínas. Os vegetais conseguem produzir todos os tipos de AA. As células animais, no entanto, não conseguem produzi–los em sua totalidade. Por isso, chamamos de naturais os aminoácidos que o organismo animal consegue produzir e de essenciais aqueles que ele só consegue adquirir pela ingestão de alimentos.
Sem eles, várias proteínas animais não seriam produzidas.
Importante:
Cada espécie na natureza apresenta uma necessidade específica de aminoácidos essenciais. Na espécie humana, os aminoácidos naturais e essenciais estão divididos em:

LIGAÇÃO PEPTÍDIA
A ligação que une os aminoácidos é chamada de ligação peptídica.

Sempre que dois aminoácidos se unem para formar um dipeptídeo, uma molécula de água (H2O) é formada.
A ESTRUTURA DAS PROTEÍNAS
Cada proteína formada tem uma ordem e sequência de AA estabelecida pelo material genético contido na célula. Essa sequência constitui a estrutura primária de uma proteína.
No entanto, a proteína não é um fio esticado, ela pode apresentar dobras e enrolamentos determinados por atrações químicas entre os aminoácidos.
Esse fio se torce, tomando geralmente a forma de uma hélice, se o filamento proteico tiver uma forma helicoidal, a sua estrutura é secundária.
Na maioria dos casos, porém, o filamento helicoidal dobra-se sobre si mesmo, de tal maneira que a molécula fica de forma arredondada, formando uma estrutura terciária.
OBSERVAÇÃO
Alguns autores consideram uma quarta forma de classificação para as proteínas. Elas são chamadas de quaternárias pelo fato de possuírem estruturas terciárias ligadas entre si.

Exemplo: Hemoglobina

Qualquer alteração na estrutura de uma proteína pode modificar a sequência de aminoácidos e, consequentemente, as propriedades da proteína. No homem, por exemplo, existe uma doença, a anemia falciforme, causada por uma modificação de apenas um único aminoácido, na molécula de hemoglobina. A hemácia portadora dessa hemoglobina anormal é frágil, tendo vida mais curta e sua destruição em grande escala causa anemia, às vezes, fatal. Além disso, em concentrações baixas de oxigenação, as hemácias se deformam, adquirindo o aspecto de foice, agrupando-se e entupindo pequenos vasos sanguíneos e reduzindo a oxigenação dos tecidos periféricos.


Alterações na forma das proteínas podem ser causadas por outros fatores, tais como altas temperaturas e variações no pH do meio. Nesses casos, falamos em desnaturação da proteína onde a perda da forma provoca a perda da sua função. A desnaturação pode ser reversível, quando as condições do meio voltam ao normal. No entanto, em muitos casos, é irreversível, como acontece com a albumina da clara do ovo; com o aquecimento, a albumina se desnatura e a clara solidifica-se; após o resfriamento, não volta a se liquefazer.
FUNÇÕES DAS PROTEÍNAS
Várias são as funções das proteínas nos seres vivos. Entre as mais importantes estão:
1 – ESTRUTURAL
Participam da estrutura de células e tecidos. Exemplos de proteínas teciduais:
• colágeno: proteína de alta resistência encontrada na pele, nas cartilagens, nos ossos e tendões.
• queratina: proteína impermeabilizante encontrada na pele, no cabelo e nas unhas. Evita a dessecação, o que contribui para a adaptação do animal à vida terrestre.

Exemplo de proteínas: Proteína transportadora ou receptora na membrana celular


2 – CONTRÁTIL
Encontradas, principalmente, nas células musculares.
Exemplos: Actina e Miosina.
3 – COAGULAÇÃO
É uma proteína que impede a perda de sangue quando um vaso é rompido.
Exemplo: Fibrinogênio.
4 – TRANSPORTE
Proteína que transporta os gases respiratórios (O2 e CO2) no sangue.
Exemplos: Hemoglobina – transporta gases no sangue.
Hemocianina – transporta O2 nos invertebrados.
5 – HORMONAL
Muitos hormônios são de natureza proteica.
Exemplos: Ocitocina – contração uterina.
Insulina – controla a taxa de açúcar no sangue (glicemia).
6 – DEFESA
Na presença de substâncias estranhas, chamadas de antígenos, o organismo produz proteínas de defesa, denominadas anticorpos de imunoglobulinas. O anticorpo combina-se, quimicamente, com o antígeno, de maneira a neutralizar o seu efeito.
A reação antígeno x anticorpo é altamente específica, o que significa que um determinado anticorpo neutraliza apenas o antígeno responsável pela sua formação.
7 – ANTÍGENO
Antígeno é qualquer substância reconhecida como estranha por um organismo, podendo ser uma molécula de proteína, de polissacarídeo e até mesmo um ácido nucleico. Nas bactérias, fungos e protozoários que invadem o homem, os antígenos são moléculas que existem nos envoltórios das células invasoras ou nas toxinas por elas produzidas. Nos vírus, os antígenos estão localizados nas capas que os revestem.
8 – ANTICORPOS
Anticorpos são moléculas de proteínas produzidas por um organismo que se destinam a combater os antígenos que o invadiram. Pertencem à categoria de proteínas conhecidas como imunoglobulinas representadas pela sigla Ig. Para cada antígeno deve ser produzido um anticorpo específico. No homem, existem cinco tipos de imunoglobulinas.
TIPOS DE IMUNOGLOBULINAS
A tabela a seguir relaciona os cinco tipos de imunoglobulinas (G – A – M – D – E) e algumas de suas características.

ANTICORPO VISTO COMO UMA MOLÉCULA
A molécula proteica de um anticorpo é complexa e possui o aspecto da letra Y. É formada por quatro cadeias de polipeptídeos, duas de pequeno peso molecular e as outras duas de alto peso molecular.

Cada cadeia polipeptídica possui uma porção variável que é a parte da molécula que difere de um anticorpo para outro. Os dois braços do Y são os locais que se ligam ao antígeno. A cauda do Y é o local de ligação do anticorpo ao receptor de membrana existente na célula de defesa.
A LIGAÇÃO DO ANTICORPO COM O ANTÍGENO
A ligação do anticorpo ao antígeno ocorre na região dos dois braços do Y. A porção variável de cada braço encaixa-se especificamente nas porções complementares existentes na molécula de antígeno, de modo semelhante ao encaixe de uma chave na fechadura.

Um vez ligados um ao outro, o anticorpo inativa o antígeno e o complexo antígeno-anticorpo formado vai ser englobado por uma célula fagocitária, que destruirá o complexo. Claro que esse anticorpo não poderá mais ser utilizado no combate aos antígenos. Por isso é que são produzidos em grande quantidade.
IMUNIZAÇÃO: A DEFESA CONTRA AS DOENÇAS
As células produzidas pelos órgãos componentes do sistema imunológico atuam na produção de anticorpos. Esses, por sua vez, combatem antígenos existentes nos micróbios causadores de infecção ou nas toxinas por eles liberadas.
Passada a infecção, de modo geral, permanece apenas um pequeno número de células de memória que poderão, caso ocorra outra infecção provocada pelo mesmo agente infeccioso, efetuar um combate rápido e eficiente.
TIPOS DE IMUNIZAÇÃO
ATIVA
Toda vez que contraímos uma virose, de modo geral ficamos imunizados contra ela. No nosso sangue permanecem as células de memória. No caso de uma reinfecção pelos mesmos vírus, essas células efetuarão um pronto combate, livrando-nos de ter a mesma virose novamente. Esse processo de imunização ativa natural funciona com a maioria das doenças infecciosas provocadas por vírus e bactérias.
Muitos vírus e bactérias, porém, são muito agressivos e é inimaginável fazer uma pessoa contrair a doença para depois ficar imune a ela. Assim, pensando-se em termos de prevenção de uma doença infecciosa, recorre-se a imunização ativa artificial a partir de vacinação das pessoas.
COMO SÃO FEITAS AS VACINAS
Micro-organismos patogênicos são multiplicados em condições especiais no laboratório. Posteriormente, esses micro-organismos são mortos ou enfraquecidos de modo a não serem capazes de provocar doença, mantendo, porém, a capacidade de funcionar como antígenos.
Exemplo:
Vacina contra a poliomielite.
Utilização de apenas uma fração do micro-organismo, que contém os antígenos como componente da vacina.
Exemplo:
Vacina contra a meningite meningocócica, em que são utilizados fragmentos das membranas que revestem as bactérias.
Utilização da toxinas, alteradas, produzidas por uma bactéria.
Exemplo:
Vacina antitetânica, preparada com toxinas alteradas da bactéria que provoca o tétano.
A RESPOSTA DO NOSSO CORPO À IMUNIZAÇÃO ATIVA
A quantidade de anticorpos produzidos durante o processo de imunização ativa é ilustrada pela figura.
A primeira injeção do antígeno provoca a chamada resposta primária, em que a produção de anticorpos é pequena. A segunda injeção provoca a resposta secundária, em que a quantidade de anticorpos produzidos é maior e a resposta é mais rápida.

De maneira geral, a primeira inoculação de antígenos em uma pessoa provoca o que se chama de resposta primária aos antígenos. Os anticorpos surgem depois de 3 a 14 dias da inoculação. Atingem certa concentração no sangue, declinando a seguir. Uma segunda inoculação de antígenos, algum tempo depois, provoca a chamada resposta secundária, muito mais rápida e produtora de maior quantidade de anticorpos em relação à resposta primária.
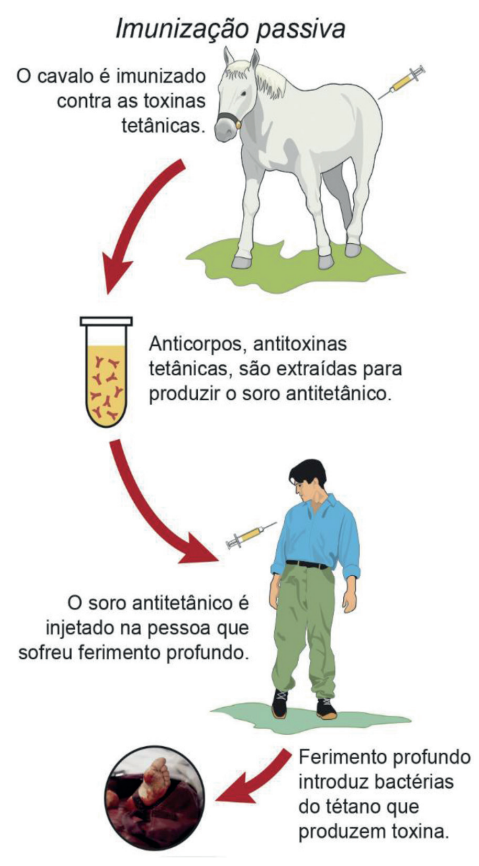
PASSIVA
Certos antígenos são tão agressivos que não é possível aguardar a produção natural de anticorpos para combatê-los. Nesses casos, recorre-se à imunização passiva, ou seja, injetam-se no organismo doente (pessoas ou animais) anticorpos específicos para combater os antígenos agressivos. Por exemplo: quando ocorrem ferimentos profundos na pele, em regiões onde há bactérias do tétano, é fundamental a injeção de soro antitetânico contendo anticorpos que possam inativar, rapidamente, as toxinas produzidas pelas bactérias.
ENZIMAS
Algumas proteínas são enzimas, isto é, proteínas que aceleram uma reação química.
Essas proteínas especiais são chamadas de catalisadores e são, talvez, as substâncias mais importantes de um organismo vivo.
As enzimas conseguem acelerar uma reação química porque elas diminuem a energia de ativação de uma reação. Isto significa, que as enzimas reduzem a “energia inicial” que todas as moléculas necessitam para começar a reagir. O calor é um bom exemplo de energia de ativação, mas em alguns casos, a quantidade de calor necessária para desencadear uma reação dentro da célula é tão alta, que acabariam destruindo a célula. E é exatamente aí que as enzimas entram na história, em reações cuja energia de ativação (a energia inicial) era alta demais e, com a enzima, sofreu uma redução.

Como qualquer catalisador, a enzima permanece intacta após a reação que ela acelerou.
Uma reação química se torna muito mais rápida em presença de uma enzima. Essa velocidade pode chegar a 100 trilhões mais rápido do que uma reação sem a enzima.
O modelo teórico para o funcionamento da enzima é o de “chave-fechadura”. Segundo esse modelo, a enzima se “encaixa” no substrato (substância química cuja transformação é acelerada pela enzima), formando um complexo.
Essa união da enzima com o substrato é transitória e é ela que permite a ação da enzima, que se separa logo em seguida. A região da molécula da enzima que se encaixa com o substrato é denominada sítio ativo.
Uma das propriedades fundamentais das enzimas é a especificidade para o substrato, isto é, cada enzima só age em um tipo de substrato. É essa especificidade que faz o nome do mecanismo “chave-fechadura” ser um bom exemplo.
Milhares de chaves e portas diferentes existem, mas somente uma chave consegue abrir determinada porta.

Conclusão: assim como no exemplo acima, o encaixe entre a enzima e o substrato depende de ajuste físico entre eles, do mesmo modo que a chave se encaixa perfeitamente a uma única e específica fechadura.
A maioria das enzimas é designada pela adição do sufixo ASE ao nome do substrato.
Exemplo: amilase, maltase e lactase.
FATORES QUE INFLUENCIAM NA ATIVIDADE ENZIMÁTICA
TEMPERATURA
A elevação da temperatura também aumenta a velocidade das reações químicas. Porém, quando a reação é enzimática, observamos que a velocidade aumenta até certo ponto e, então, começa a diminuir.
Esse prejuízo na velocidade, a partir de uma determinada temperatura, é consequência da desnaturação da enzima pelo excesso de calor. Seu perfil se modifica, dificultando o encaixe do substrato.
Se a desnaturação for crescente, a velocidade tende a chegar a zero, podendo até mesmo parar.

Cada enzima exige um pH específico para funcionar. A pepsina, enzima que “quebra” as proteínas, presentes no suco gástrico, só atua em pH ácido (entre 1,8 e 2,2). Já a tripsina que também degrada as proteínas atua no intestino delgado com um pH ao redor de 8,0.
CONCENTRAÇÃO DO SUBSTRATO
A velocidade da ação da enzimática é também proporcional à concentração do substrato do meio. Quanto maior for a concentração do substrato, mais rapidamente se dará a reação.
Neste caso também, há um “ponto ótimo” a partir do qual se aumenta a concentração do substrato, sendo assim, a velocidade da reação não aumentará mais, atingindo sua velocidade máxima.






